Axit Bromhidric là gì?
- Axit bromhidric được biết đến là một axit mạnh và được tạo thành khi hòa tan phân tử khí hidro bromua trong nước.
- Axit bromhidric mạnh hơn axit clohidric, tuy nhiên lại yếu hơn axit iothidric, và là một trong các axit vô cơ mạnh nhất được biết đến.
- Công thức phân tử được viết như sau: \(HBr\).
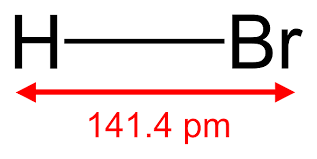 khái niệm Axit bromhidric là gì
khái niệm Axit bromhidric là gì
Tính chất vật lý của Axit Bromhidric
- \(HBr\) là chất lỏng không màu và tan trong nước.
- Khối lượng mol: \(80,91g/mol\)
- Khối lượng riêng: \(1,49g/m3\)
- Nhiệt độ nóng chảy: \(−11∘C\)
- Nhiệt độ sôi: \(122∘C\)
- Hằng số điện li pKa: \(-9\)
Tính chất hóa học của Axit Bromhidric
Axit Bromhidric chính là một axit mạnh, chính vì thế mà nó có đầy đủ tính chất của một axit như sau:
Làm thay đổi chất chỉ thị màu
Axit Bromhidric làm đổi màu quỳ tím thành đỏ
Tác dụng với phi kim
\(O_{2}+4HBr→2Br_{2}+2H_{2}O\)
\(Cl_{2}+2HBr→Br_{2}+2HCl\)
Tác dụng với kim loại tạo thành muối và giải phóng khí hiđro
\(2Al+6HBr→3H_{2}+2AlBr\)
\(Mg+2HBr→H_{2}+MgBr_{2}\)
\(Fe+2HBr→H_{2}+FeBr_{2}\)
Tác dụng với bazơ tạo thành muối và nước
\(NaOH+HBr→H_{2}O+NaBr\)
\(Al(OH)_{3}+HBr→H_{2}O+AlBr_{3}\)
Tác dụng với oxit bazơ tạo thành muối và nước
\(MnO_{2}+4HBr→Br_{2}+2H_{2}O+MnBr_{2}\)
\(8HBr+Fe_{3}O_{4}→4H_{2}O+FeBr_{2}+2FeBr_{3}\)
Tác dụng với muối tạo ra muối mới và axit mới
\(AgNO_{3}+HBr→AgBr+HNO_{3}\)
\(FeS+2HBr→H_{2}S+FeBr_{2}\)
Những ứng dụng của Axit Bromhidric
- Axit bromhidric thường sử dụng chủ yếu để điều chế các muối bromua, đặc biệt là kẽm bromua, canxi bromua cũng như natri bromua.
- Đây cũng được xem như một chất hữu ích trong việc điều chế các hợp chất brom hữu cơ. Một số ete bị phân ly khi dùng \(HBr.\)
- Axit bromhidric cũng là chất xúc tác cho các phản ứng ankyl hóa và giúp tách chiết các quặng.
- Một trong những hợp chất brom hữu cơ quan trọng trong công nghiệp được điều chế từ HBr là anlyl bromua, axit bromaxetic và tetrabromobisphenol.
Cách điều chế Axit Bromhidric
Trong phòng thí nghiệm
- Axit bromhidric thường được điều chế trong phòng thí nghiệm qua phản ứng giữa \(Br2,SO_{2}\) cùng với nước.
\(Br_{2}+SO_{2}+2H_{2}O→H_{2}SO_{4}+2HBr\)
- Một cách điều chế điển hình hơn chính là cho khí hiđro bromua hòa tan trong nước.
Trong công nghiệp
- Axit bromhidric thường được điều chế trong công nghiệp qua việc thủy phân triphotpho bromua, tuy nhiên thực tế là cho \(Br2 \) tác dụng trực tiếp với lưu huỳnh hoặc phốt pho và nước.
\(PBr_{3}+3H_{2}O→H_{3}PO_{3}+3HBr\)
- Việc điện phân dung dịch cũng tạo ra \(HBr\).
Bài tập về Axit Bromhidric
Bài 1: Tính khử của \(HBr\) (ở trạng thái khí cũng như trong dung dịch) mạnh hơn \(HCl\). Hãy lập PTHH của các phản ứng trong 2 trường hợp sau :
- \(HBr\) khử \(H_{2}SO_{4}\) đến \(SO_{2}\)
- Dung dịch\( HBr \) không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hoá bởi \(O_{2}\) của không khí.
Cách giải:
- \(2HBr+H_{2}SO_{4}→Br2+SO_{2}+2H_{2}O\)
- \(4HBr+O_{2}→2Br_{2}+2H_{2}O\)
Bài 2: Đổ dung dịch chứa 2 gam \(HBr\) vào dung dịch chứa 2 gam \(NaOH\). Nhúng giấy quỳ tìm vào dung dịch thu được thì quỳ tím chuyển màu gì?
Cách giải:
Ta có:
\(MHBr>MNaOH\)
\(⇒nHBr<nNaOH\)
Vậy dung dịch sẽ dư \(NaOH\), nhúng giấy quỳ tím vào thì quỳ tím chuyển sang màu xanh.
Bài 3: Một ancol X tác dụng với \(HBr\) được dẫn xuất Y chứa \(58,4% brom \) brom về khối lượng. Tìm CTPT của X biết X là ancol no, đơn chức, mạch hở.
Cách giải:
Gọi CTPT của ancol là \(C_{n}H_{2n+2}O\)
\(⇒\) CTPT của sản phẩm thu được là \(C_{n}H_{2n+1}Br\)
%\(m_{Br} = \frac{80}{14n + 81}.100\)\(= 58,4%\)
\(⇒n=4\)
Vậy CTPT của X là \(C_{4}H_{10}O\)
Bài 4: Ở điều kiện tiêu chuẩn, 1 lít nước hòa tan 350 lít khí \(HBr.\) Tính nồng độ phần trăm của dung dịch axit bromhidric thu được.
Cách giải:
Ta có:
\(n_{HBr} = \frac{350}{22,4} = 15,625\, (mol)\)
\(\Rightarrow m_{HBr} = 15,625 .81 = 1265,625\, (gam)\)
\(m_{dd} = m_{HBr} + m_{H_{2}O} = 1265,625 + 1000 = 2265,625\, (gam)\)
Vậy C% HBr = \(\frac{1265,625.100}{2265,625}\) = 55,86%
Bài 5: Nhận biết các chất sau: \(NaCl, HCl, NaOH, Na_{2}SO_{4}, H_{2}SO_{4}, HBr, Ba(OH)_{2}\)
Cách giải:
Sử dụng vào quỳ tím:
- Chất làm quỳ tím chuyển đỏ là \(HCl, H_{2}SO_{4}, HBr\) (1)
- Chất làm quỳ chuyển xanh là: \(NaOH,Ba(OH)_{2}\) (2)
- Chất không làm quỳ tím chuyển màu: \(NaCl,Na_{2}SO_{4}\) (3)
Cho nhóm (1) tác dụng với \(AgNO_{3}\)
- Chất nào làm xuất hiện kết tủa trắng là \(HCl\)
\(AgNO_{3}+HCl→AgCl+HNO_{3}\)
- Chất nào làm xuất hiện kết tủa vàng nhạt là \(HBr\)
\(AgNO_{3}+HBr→AgBr+HNO_{3}\)
- Chất còn lại là \(H_{2}SO_{4}\)
Cho nhóm (2) tác dụng với \(H_{2}SO_{4}\)
- Chất nào làm xuất hiện kết tủa trắng là \(Ba(OH)2\)
\(H_{2}SO_{4}+Ba(OH)_{2}→2H_{2}O+BaSO_{4}\)
- Chất còn lại là \(NaOH\)
\(H_{2}SO_{4} + NaOH \rightarrow H_{2}O + NaHSO_{4}\)
Cho nhóm (3) tác dụng với \(Ba(OH)_{2}\)
- Chất nào làm xuất hiện kết tủa trắng là \(Na_{2}SO_{4}\)
\(Na_{2}SO_{4} + Ba(OH)_{2} \rightarrow 2NaOH + BaSO_{4}\)
- Chất không có hiện tượng gì là \(NaCl\).
Như vậy, DINHNGHIA.VN đã giúp bạn tổng hợp chi tiết các kiến thức về axit bromhidric. Nếu có bất cứ câu hỏi hay đóng góp gì về nội dung bài viết, đừng quên để lại ở nhận xét bên dưới nhé!.